पानी के गुण: आइसोटोप और आणविक संरचना।
पानी के गुण 1: सामान्य
पानी 2 के गुण: भौतिक और रासायनिक गुण
पानी की समस्थानिक रचना
जल, नाभिक में प्रोटॉन से जुड़े न्यूट्रॉन की संख्या में ऑक्सीजन और हाइड्रोजन के आइसोटोप के विभिन्न संयोजनों का मिश्रण होता है।
1H,2 एच (ड्यूटेरियम)3एच (ट्रिटियम)
16O, 17O,18O.
समस्थानिक अनुपात हैं:
हाइड्रोजन के लिए:
2H/1एच = 1 / 6900
3H/1एच = 1 / 10 18
ट्रिटियम एक अस्थिर तत्व, अपने समय के आधा (जीवन) 12,5 वर्ष है।
ऑक्सीजन के लिए:
18O/16हे = 1 / 500
17O/16हे = 1 / 2500
4 मुख्य आणविक प्रजातियों और उनकी आवृत्ति इस प्रकार है:
1H216हे = 99,7%
1H2 18 हे = 0,2%
1H217हे = 0,04%
1HD16हे = 0,03%
D216हे = बहुत कम
विभिन्न आइसोटोप विशेष उनके घनत्व में, अणुओं के भौतिक गुणों में मतभेद प्रेरित है, लेकिन रासायनिक गुण ही रहते हैं।
भारी पानी डी2ओ अपनी प्राकृतिक अवस्था में मौजूद है, लेकिन बहुत में
कम। एक प्रशंसनीय मात्रा होने के लिए, आइसोटोप जुदाई की तकनीकों में महारत हासिल करना आवश्यक है: परमाणु हथियार तैयार करने के लिए पिछले विश्व युद्ध के दौरान यह मूलभूत चुनौतियों में से एक था।
तापमान जैसे थर्मोडायनामिक मापदंडों के अनुमान में पानी के रासायनिक घटकों की समस्थानिक संरचना का उपयोग किया जाता है;
रिपोर्ट 18 O/16O ध्रुवीय कैप से बर्फ और जीवाश्म भूजल से पानी अतीत की जलवायु के बारे में जानकारी प्रदान करता है।
महासागरीय जल का वाष्पीकरण समस्थानिक विभाजन के साथ होता है: ऑक्सीजन का प्रकाश समस्थानिक भारी आइसोटोप की प्राथमिकता में विकसित होता है। बादल और वर्षा के पानी की तुलना में महासागर भारी आइसोटोप में समृद्ध हैं।
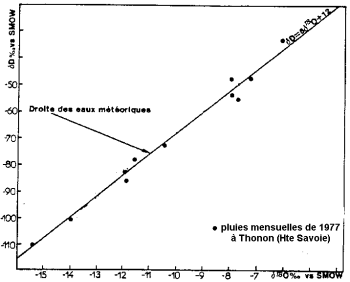
वर्षा की स्थिर आइसोटोप सामग्री (ब्लावौक्स और लेटोले के बाद, 1995)।
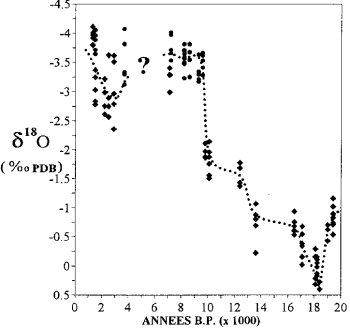
मैयट में कोरल में ऑक्सीजन आइसोटोप सामग्री में भिन्नता (कैसानोवा एट अल।, 1994 के बाद)।
अणु की संरचना
हाइड्रोजन और ऑक्सीजन परमाणु अपने इलेक्ट्रॉनों को नियॉन की तरह एक पूरी परत बनाने के लिए पूल करते हैं। वास्तव में, ऑक्सीजन परमाणु में अपने इलेक्ट्रॉनिक शेल को पूरा करने के लिए 2 इलेक्ट्रॉनों का अभाव है, यह 2 हाइड्रोजन परमाणु हैं जो इसे प्रदान करते हैं। गठित H2O अणु स्थिर है।
ऑक्सीजन: 8 8 प्रोटॉन + न्यूट्रॉन
हाइड्रोजन: 2 (2 * (1 1 न्यूट्रॉन प्रोटॉन +))
कुल: प्रोटॉन 10 10 इलेक्ट्रॉनों का भार संतुलन।
हाइड्रोजन के नाभिक में ऑक्सीजन का एक पक्ष होता है ताकि एक विशेषता "मिक्की का सिर" (हाइड्रोजन कान हो)।
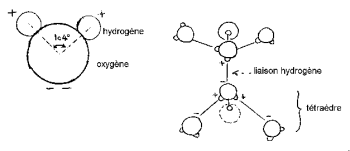
HOH कोण 104,474 ° (टेट्राहेड्रल ज्यामिति की विशेषता) है। ऑक्सीजन और हाइड्रोजन परमाणु के बीच की दूरी भाप में 1 A ° (0,95718 A °) के करीब है। अणु का प्रभावी व्यास 2,82 ए ° के क्रम का है।
इस छोटे अणु में विद्युत आवेश असमान रूप से वितरित होते हैं। इलेक्ट्रॉनों हाइड्रोजन परमाणु की तुलना में ऑक्सीजन परमाणु के लिए अधिक दृढ़ता से आकर्षित होते हैं। हाइड्रोजन नाभिक के पास सकारात्मक चार्ज के 2 केंद्र और ऑक्सीजन नाभिक के पास नकारात्मक चार्ज के 2 केंद्र हैं। पानी के अणु के गैर-रेखीय ज्यामिति के साथ संयुक्त आरोपों के वितरण में यह असंतुलन, एक मजबूत विद्युत द्विध्रुवीय क्षण के अस्तित्व में प्रकट होता है। पानी का अणु ध्रुवीय है; यह एक विद्युत द्विध्रुवीय की तरह व्यवहार करता है जो इस प्रकार अन्य ध्रुवीय अणुओं के साथ बाँध सकता है। दरअसल, क्रिस्टल के घटक आयनों के बीच पानी के अणुओं को उनके विपरीत विद्युत आवेश के अपने हिस्से को निर्देशित करके डाला जा सकता है। क्रिस्टलीय आयनों का आकर्षण बहुत कमजोर हो जाता है और क्रिस्टल का सामंजस्य कम हो जाता है, जिससे इसके विघटन में आसानी होती है। पानी के अणु के ध्रुवीय गुण माइक्रोवेव हीटिंग की तकनीक की व्याख्या करते हैं। वास्तव में, एक ध्रुवीकृत अणु एक विद्युत क्षेत्र के संबंध में खुद को पेश करता है; यदि यह बदलता है, तो अणु अभिविन्यास में परिवर्तन का अनुसरण करता है। एक निश्चित आवृत्ति से, पानी के लिए कुछ गीगाहर्ट्ज, अणुओं के आंदोलनों से घर्षण से गर्मी पैदा होती है। घरेलू ओवन आमतौर पर 2,45 GHz की आवृत्ति पर काम करते हैं, जो कि UHF है।
अणु के 3 नाभिक स्थिर नहीं होते हैं, वे एक दूसरे के सापेक्ष चलते हैं, अणु हिलता है और मुड़ता है। तरल पानी में, अणु संबद्ध होते हैं: मिकी के सिर बंधन को हाइड्रोजन बंधन द्वारा ठोड़ी तक बांधे जाते हैं। वास्तव में, ऑक्सीजन के 8 परिधीय इलेक्ट्रॉनों में, केवल 4 हाइड्रोजन परमाणुओं के साथ सहसंयोजक बंधन में शामिल हैं। शेष 4 इलेक्ट्रॉनों को 2 जोड़े में विभाजित किया जाता है जिन्हें मुक्त इलेक्ट्रॉन युगल कहा जाता है। इनमें से प्रत्येक नकारात्मक विद्युत आवेशित युगल एक इलेक्ट्रोस्टैटिक बंधन का निर्माण कर सकता है, जो पास के पानी के अणु के सकारात्मक चार्ज हाइड्रोजन परमाणु के साथ हो सकता है। हाइड्रोजन बॉन्ड, जो कमरे के तापमान पर स्थिर है, फिर भी सहसंयोजक बंधन की तुलना में नाजुक है। पानी के अणु में, 2 सहसंयोजक बंधों की दिशा में गठित ज्यामिति और 2 मुक्त इलेक्ट्रॉनिक युगल एक टेट्राहेड्रोन के करीब होते हैं, जिसका केंद्र ऑक्सीजन नाभिक द्वारा कब्जा कर लिया जाता है।
हालांकि, पानी के अणु की बड़े पैमाने पर संरचना अभी भी अपूर्ण रूप से ज्ञात है। एक्स-रे और न्यूट्रॉन विवर्तन स्पेक्ट्रा 2 मुख्य मूल्य प्रदान करते हैं: 1 ए ° के अनुरूप सिग्नल, हाइड्रोजन और ऑक्सीजन नाभिक के बीच की दूरी, और तापमान के अनुसार 2,84 से 4 ए ° के बीच का मान: 2 ऑक्सीजन नाभिक के बीच की दूरी के अनुरूप। एक्स-रे डिफ्रेक्टोमेट्री भी किसी दिए गए अणु से दूरी R पर स्थित तरल की प्रति इकाई मात्रा में अणुओं की औसत संख्या को जानना संभव बनाती है। एक पानी के अणु में औसतन 4,4 पड़ोसी होते हैं, जो टेट्राहेड्रल मेष का सुझाव देते हैं। हाइड्रोजन बांड से जुड़े अणुओं के अलावा, अन्य अनबाउंड अणु हैं, जो समझा सकते हैं कि पड़ोसी अणुओं की संख्या 4 से थोड़ा अधिक क्यों है, और सख्त टेट्राहेड्रल क्रिस्टलीकृत राज्य द्वारा आवश्यक रूप से 4 बिल्कुल नहीं। हाइड्रोजन बांडों द्वारा जुड़े अणुओं के क्रिस्टल जाली गुहाओं का निर्माण करेंगे जहां अनबाउंड अणु रखे जाएंगे। एक और परिकल्पना हाइड्रोजन बांड के विरूपण पर आधारित है। उत्तरार्द्ध, मूल रूप से रैखिक, जो कि ओ - हो परमाणुओं के साथ गठबंधन करने के लिए कहते हैं, डिग्री को अलग कर सकते हैं और उन अणुओं को अनुमति दे सकते हैं जो केंद्रीय अणु के करीब पहुंचने के लिए करीबी पड़ोसियों से अधिक दूर हैं।
सैद्धांतिक मॉडल हाल ही में शक्तिशाली कंप्यूटरों का उपयोग करके विकसित किए गए हैं। वे संकेत देते हैं कि लगभग 80% पानी के अणु 3 या 4 हाइड्रोजन बांड में शामिल हैं; दूसरी ओर, वे अनबाउंड अणुओं की उपस्थिति को बाहर करते हैं। कंप्यूटर मॉडलिंग से पता चलता है कि जैसे ही पानी ठंडा होता है, अणुओं के नेटवर्क तेजी से बर्फ के समान हेक्सागोन के समान हो जाते हैं।
ठोस अवस्था एक सख्त क्रिस्टलीय व्यवस्था से मेल खाती है। साधारण दबाव में, बर्फ में एक षट्कोणीय संरचना होती है। कम तापमान (-80 डिग्री सेल्सियस से नीचे) पर, यह एक घन संरचना ले सकता है। इलेक्ट्रिक चार्ज क्रिस्टल जाली में स्थानांतरित हो सकते हैं और आयनिक प्रकार के क्रिस्टल दोष उत्पन्न कर सकते हैं: हाइड्रेटेड प्रोटॉन H3O + और हाइड्रॉक्सिल आयन OH-। बर्फ का क्रिस्टल जाली अणुओं के सबसे कॉम्पैक्ट संभव स्टैकिंग के अनुरूप नहीं है। संलयन होने पर, दोष गिर जाते हैं क्योंकि हाइड्रोजन बंधन टूट जाते हैं और अणु एक साथ करीब आते हैं: घनत्व अधिकतम 4 ° C पर बढ़ जाता है। इसके बाद, तरल पानी में, तापमान में वृद्धि अणुओं को अलग करती है और घनत्व कम हो जाती है।
विवरण, संदर्भ और ग्रंथ सूची:
ब्लावौक्स बी और लेटोले आर (1995) - भूजल के ज्ञान के लिए समस्थानिक तकनीकों का योगदान। जियो सिंक्रोनिक्स, 54, पी। 12-15।
कारो पी। (1990) - पानी के भौतिक और रासायनिक गुण। पानी की महान पुस्तक, ला विलेट, पी। 183-194।
ईगलैंड डी। (1990) - पानी की संरचना। द रिसर्च, 221, पी। 548-552।
Maidment DR (1992) - जल विज्ञान की पुस्तिका। मैक ग्रे हिल।
कैसानोवा जे।, कोलोना एम। और जेर्रॉउड के। (1994) - भू-आकृति विज्ञान - पैलियोक्लामियालॉजी। आरएपीपी। scient। बीआरजीएम, पी। 76-79।

